Espace mort : présentation et rôle dans la cicatrisation des plaies
Dans la section suivante, retrouvez :

La notion d’espace mort peut être transposée à toutes les plaies présentant une perte de substance non suturée. Il correspond alors à un espace situé entre le pansement et le lit de la plaie, une cavité qui apparaît lorsque le pansement n’épouse pas totalement le lit de la plaie et dans laquelle l’exsudat va pouvoir s’accumuler2,3.
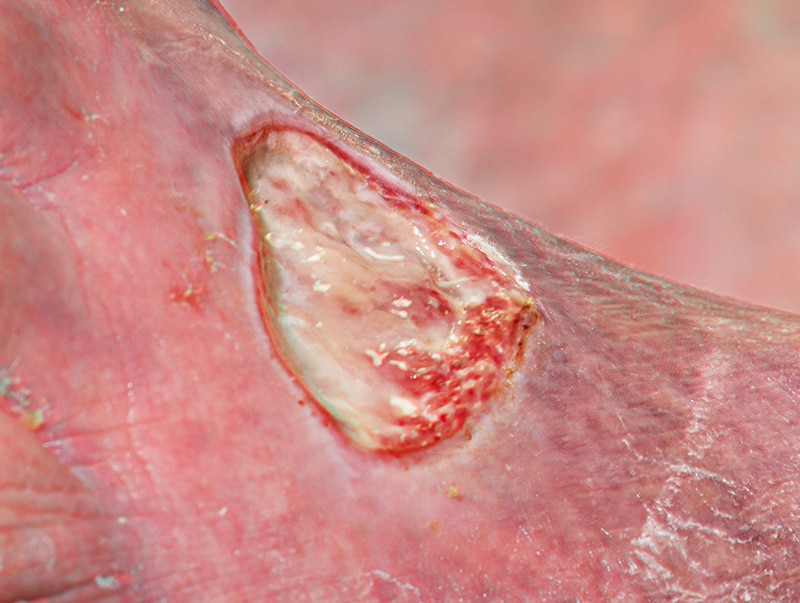
Dans le cadre de plaies avec des atteintes profondes, comme par exemple certains ulcères, une cavité peut apparaître sous les berges de la plaie. Cette cavité, si elle n’est pas suffisamment épousée par le pansement, peut alors elle aussi se transformer en espace mort3.
La formation d’un espace mort aura des conséquences importantes sur l’évolution de la plaie et son processus cicatriciel3,4.
2. Quelles sont les conséquences de l’espace mort sur la cicatrisation des plaies ?
La formation d’un espace mort va avoir différentes conséquences négatives sur l’évolution de la plaie2.
Sa prise en charge est impérative afin d’éviter de futures complications1. Pour en savoir plus sur la prise en charge des espaces morts, consultez notre page dédiée ici.
Espace mort et accumulation d’exsudat :
Si l’exsudat a un rôle physiologique essentiel dans la cicatrisation des plaies, son accumulation peut avoir des conséquences négatives importantes. Pour en savoir plus, consultez la page dédiée à l’exsudat ici.
L’apparition d’un espace mort entre le pansement et le lit de la plaie va favoriser l’accumulation de l’exsudat. Les fuites de liquide en découlant vont induire une macération de la peau périlésionnelle, un élargissement de la plaie et un retard de cicatrisation.
La formation d’un réservoir d’exsudat dans l’espace mort est également un facteur de risque d’infection. En effet, l’exsudat contient une grande quantité d’enzymes et de protéases susceptibles de retarder la guérison, ainsi que des protéines favorisant la croissance bactérienne. De ce fait, les réservoirs d’exsudat favorisent la croissance des bactéries, augmentant ainsi le risque d’infection et le développement secondaire d’un biofilm2.
Espace mort et forces biomécaniques :
La présence d’un espace mort va retarder la cicatrisation en modifiant les phénomènes physico-physiologiques normalement impliqués dans ce processus.
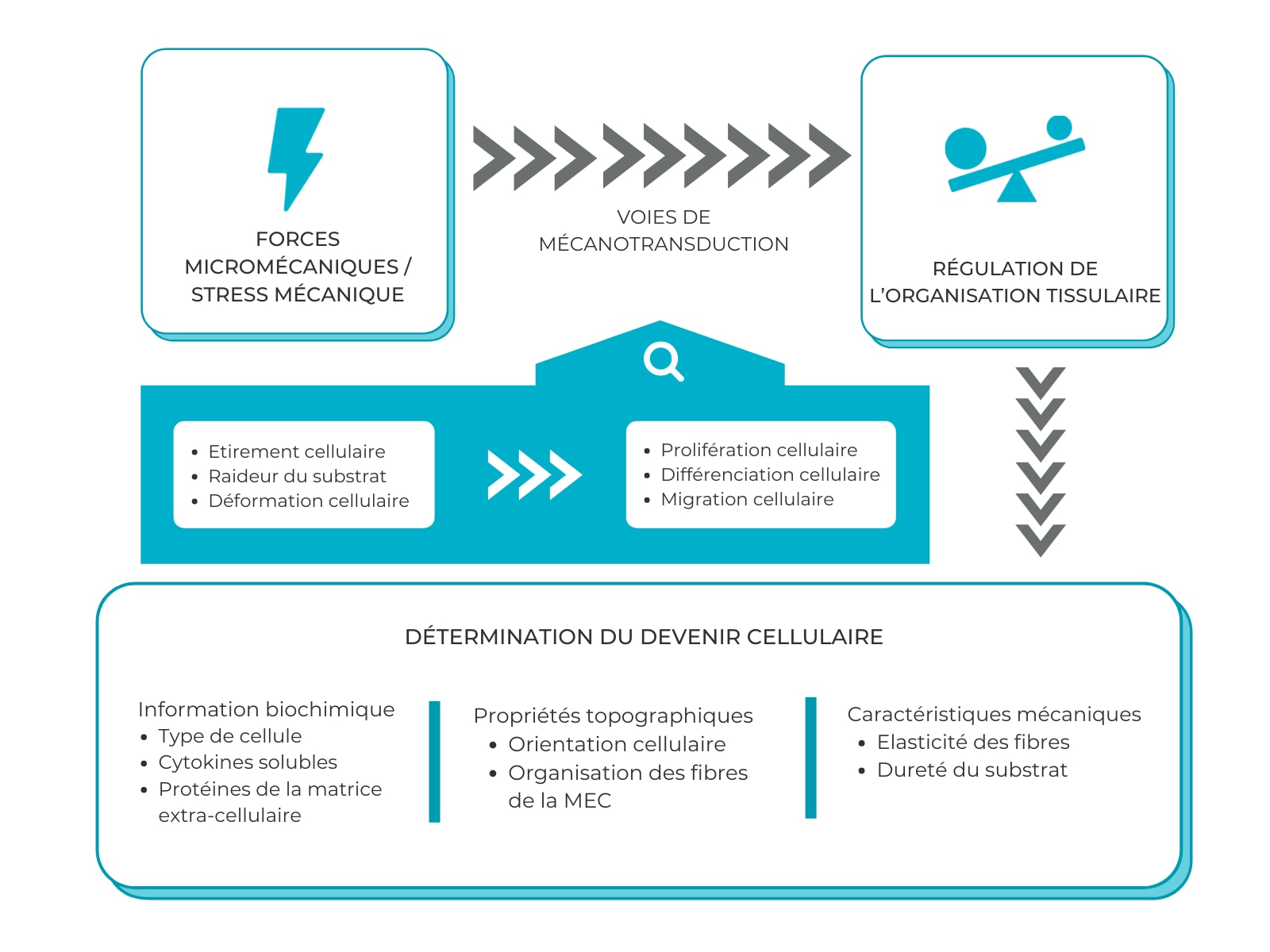
La cicatrisation est un processus complexe faisant intervenir différents paramètres chimiques et physiques. En effet, si elle débute au niveau cellulaire par différentes étapes de recrutement et de migration, des forces biomécaniques sont également impliquées dans la régulation du devenir des cellules.
Les forces micromécaniques influencent grandement l’organisation et le comportement des cellules. En effet, en conditions physiologiques, les cellules répondent au stress par des changements de conformation et de métabolisme jusqu’à ce qu’un état acceptable soit à nouveau atteint. Cependant, en l’absence de stimulus mécanique, comme dans le cas d’une plaie avec une perte de substance importante ou lors de l’apparition d’un espace mort, les cellules arrêtent de proliférer, stoppent leur migration, interrompent leur cycle cellulaire et peuvent même entrer en apoptose et mourir5.
Les forces micromécaniques régulent l’organisation tissulaire via des voies de mécanotransduction. Le devenir des cellules est de ce fait déterminé par les signaux biochimiques, les propriétés topographiques du tissu et ses caractéristiques mécaniques5.
La réactivité mécanique de la matrice extra-cellulaire est un déterminant essentiel du devenir cellulaire. Elle est en effet impliquée dans la communication inter-cellulaire et dans la réponse des cellules à leur environnement. L’organisation et les caractéristiques mécaniques des fibres de la matrice auxquelles s’attachent les cellules complètent les signaux biochimiques afin d’assurer l’intégrité tissulaire.
Dans le cas d’une plaie chronique, la matrice extra-cellulaire est dégradée et ne fournit de ce fait pas les signaux nécessaires à la migration cellulaire et à la régénération tissulaire5.
Lorsqu’un espace mort se créé, le vide empêche la transmission des signaux biomécaniques, entraînant ainsi la perte des signaux indispensables à la régénération cellulaire et tissulaire. La perte de la tension tissulaire au niveau de la plaie entraîne celle des signaux mécaniques indispensables à la prolifération, à l’alignement et à la contraction des cellules. La cicatrisation de la plaie est alors au mieux retardée, au pire impossible dans ces conditions5.
Les questions clés des effets des microdéformations dans la cicatrisation5
Quelle est l’importance des microdéformations dans la cicatrisation ?
Les signaux mécaniques favorisent la prolifération et la migration cellulaires et augmentent l’expression des composants de la MEC ; des éléments contractiles et des facteurs de croissance nécessaires à la cicatrisation.
L’espace mort perturbe-t-il la propagation des signaux mécaniques ?
Les besoins structurels nécessaires au fonctionnement cellulaire physiologique sont absents dans les plaies chroniques. La perte des signaux mécaniques stimulateurs ralenti la prolifération et la migration cellulaire. De ce fait, la formation d’un espace mort entrave la cicatrisation.
Comment les microdéformations peuvent-elles induire la prolifération cellulaire ?
La tension mécanique induit une déformation du cytosquelette qui va initier les cascades de signalisation menant, par exemple, à la libération de facteurs de croissance promouvant la prolifération cellulaire.
Quel est le rôle joué par les fibroblastes, les myofibroblastes et les CSM ?
Les fibroblastes produisent le tissu connectif et restaurent la force mécanique. Les fibroblastes vieillissants montrent un taux de prolifération et de migration diminué et le nombre de fibroblastes est réduit dans les plaies qui ne guérissent pas. Les myofibroblastes sont des cellules contractiles qui remodèlent la MEC afin de diminuer la surface de la plaie. En l’absence de stimuli mécaniques, due à la diminution des propriétés mécaniques de la MEC dans les plaies chroniques, elles échouent à remplir leur rôle. Les cellules souches mésenchymateuses (CSM) ont des effets anti-inflammatoires et antibactériens, induisent l’angiogenèse et recrutent d’autres cellules. Elles sont contrôlées par la tension cellulaire et les stimuli mécaniques. La perte de transduction des forces mécaniques au sein des plaies chroniques peut arrêter l’activité des CSM.
POUR ALLER PLUS LOIN
- Notre service Coloplast Conseils professionnels de Santé
- Nos produits (Portail MedOK)
Références
- Snyder RJ. Managing dead space: an overview. Podiatry management. 2005:171-172.
- Dowsett C et al. Meeting report: The gap challenge in clinical practice — how do you manage it? Wounds International 2018;9(3):60-65.
- Dowsett C, et al. A focus on the Triangle of Wound Assessment — addressing the gap challenge and identifying suspected biofilm in clinical practice. Wounds International 2019;10(3):34-39.
- Keast DH, et al. Managing the gap to promote healing in chronic wounds — an international consensus. Wounds International 2020;11(3):58-63.
- Wiegand C, White R. Microdeformation in wound healing. Wound Rep Reg. 2013:21;793–799.